미토콘드리아로 약물 정확히 전달·방출하는 나노겔 개발
 2023-11-29
2023-11-29

미토콘드리아로 약물 정확히 전달·방출하는 나노겔 개발
소수성 라이신과 이황화결합 나노겔로 항암제 효능 개선 기대
약물의 효능을 극대화하고, 부작용은 최소화하기 위해 약물을 표적까지 정확하게 전달·방출하는 '나노약물전달체'연구가 세계적으로 활발한 가운데, 국내 연구진이 약물을 세포소기관*에 정확하게 전달하고, 방출하는 새로운 '나노약물전달체' 설계 전략을 제시했습니다.
한국연구재단은 강한창 교수(가톨릭대학교) 연구팀이 생체에너지 생산 및 세포사멸을 담당하는 세포소기관인 ‘미토콘드리아’를 표적으로 약물을 전달·방출하는 나노겔을 개발하고, 세포 및 동물실험을 통해 항암제의 효능 개선 효과를 확인했다고 밝혔습니다.
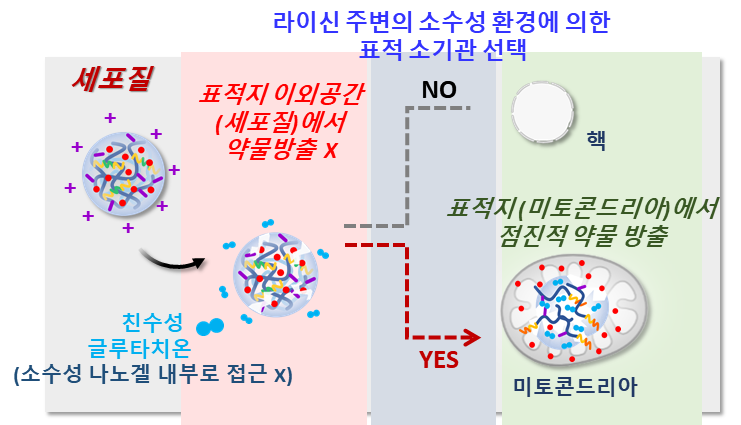 미토콘드리아 표적 약물 전달 및 방출 나노겔의 세포 내 작용 개념(© 2022 Elsevier B.V. All rights reserved.)
미토콘드리아 표적 약물 전달 및 방출 나노겔의 세포 내 작용 개념(© 2022 Elsevier B.V. All rights reserved.)
기존의 나노약물전달체는 약물을 표적까지 전달하는 능력은 우수하지만, 표적지에서 방출하는 능력은 미흡한 실정입니다. 표적 방출을 유도하기 위해 효소 및 활성산소종 등의 자극을 활용하는데, 이들 자극은 세포 밖은 물론 세포질에도 존재하여 나노약물전달체가 표적에 도달하기 전 약물이 방출될 가능성이 높기 때문입니다.
연구팀은 약물이 세포소기관에 전달된 후, 방출되도록 나노약물전달체의 ‘표적 전달’과 ‘표적 방출’이 순차적으로 진행되는 새로운 미토콘드리아 표적 약물 전달 및 방출 설계 전략을 마련하였습니다.
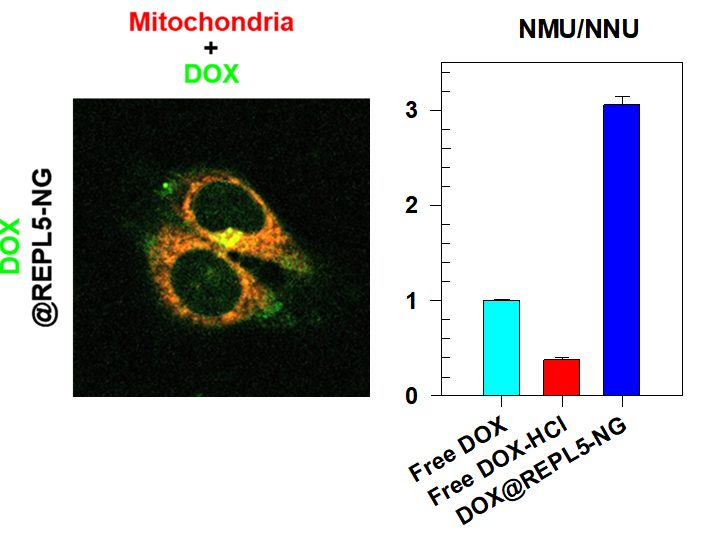
나노겔의 미토콘드리아 표적능(© 2022 Elsevier B.V. All rights reserved
연구팀은 미토콘드리아로의 전달에 영향을 주는 소수성 라이신 기반의 나노겔을 만들어 약물이 세포의‘핵 보다 미토콘드리아’로 더 갈 수 있는 ‘표적 전달’을 구현하였습니다. 또한 분해 자극인 글루타치온이 친수성임을 고려해 이황화 결합부위 환경을 소수성화하고 나노겔 내 이황화 결합부위에 글루타치온의 접근을 제한 또는 지연시켜 세포질 글루타치온 보다 미토콘드리아 글루타치온에 의해 이황화 결합이 분해되는 ‘표적 방출’을 성공시켰습니다.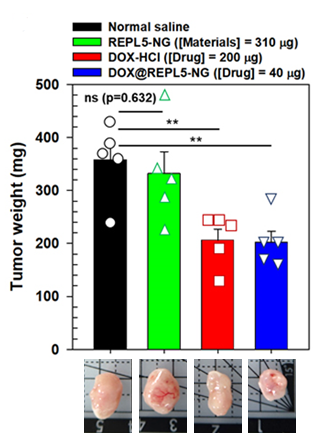
새로운 약물봉입 나노겔을 이용한 대장암모델 마우스 실험결과 약물의 양을 기존 5분의 1로 줄였음에도 암성장 억제능력이 기존과 유사하거나 좀 더 우수함이 확인되었습니다. 한편 라이신 기반의 환원분해성 나노겔은 체내 투여부터 표적 방출까지 혈액 중 순환, 암세포 내로의 유입, 엔도솜/리소솜 탈출, 표적 세포소기관 내로의 유입, 표적 세포소기관 내에서의 방출 등 5가지 장애물을 효과적으로 극복할 수 있습니다.
강한창 교수는 “이번 연구는 표적 세포소기관에 존재하는 분해 자극을 찾아, 정확한 약물방출을 유도하는 나노약물전달체를 개발한 데 의의가 있다”라며 “신규 나노젤이 다양한 질환의 예방 및 치료에 적용될 수 있도록 후속연구에 힘쓰겠다”라고 밝혔습니다.
이번 연구의 성과는 화학공학 분야 국제학술지 ‘케미컬 엔지니어링 저널(Chemical Engineering Journal)’에 1월 25일 게재되었습니다.

- 다음
- 한 장의 사진으로 뇌혈관 혈류 속도 측정한다 2023.12.05
- 이전
- 그린수소 생산 열쇠 '스핀 제어 광전극' 개발 2023.11.24
댓글 남기기
전체 댓글수 0





























